L’unité U1176 est composée de 3 thèmes :
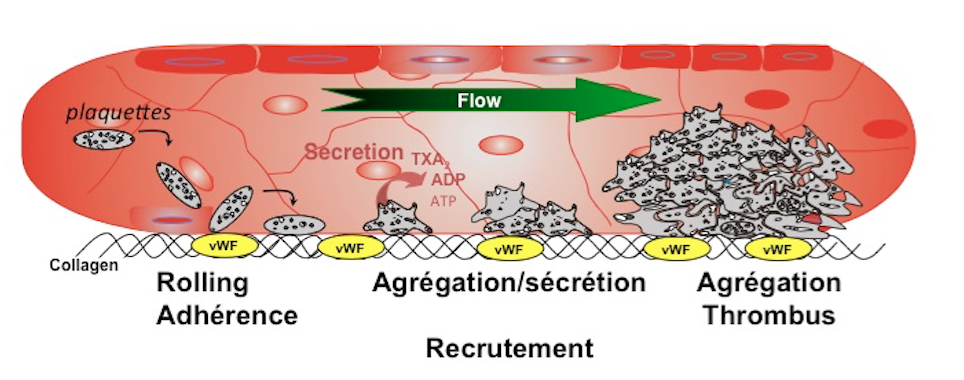
Le thème plaquettes/aspects cellulaires et vasculaires a pour but de décrypter les mécanismes cellulaires et moléculaires, aussi bien fondamentaux que pathologiques, régulant la quantité de plaquettes et leurs fonctions hémostatiques. Les plaquettes jouent un rôle clé dans l’arrêt du saignement, les recherches au sein de l’unité INSERM abordent les différents versant de l’activation plaquettaire aussi bien les phases précoces que les phases plus avancées comme la formation du thrombus (figure ci-dessous).
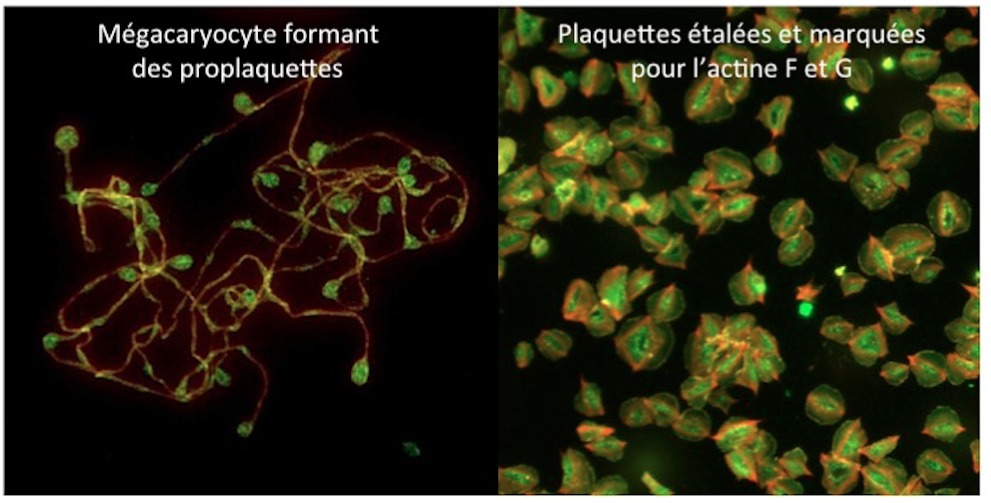
 Un des axes de recherche porte sur l’implication du cytosquelette, des protéines de signalisation et de la régulation de la signalisation calcique, (notamment les pompes Serca3), dans la formation et l’activation des plaquettes. Le cytosquelette est un acteur essentiel par son implication sur leur formation, la morphologie des plaquettes, la sécrétion,… Mieux comprendre, mais également définir de nouveaux acteurs impliqués dans ces mécanismes, sont des enjeux essentiels notamment dans des pathologies induisant des défauts morphologiques (macro- ou microplaquettes) ou encore du nombre de plaquettes (thrombopénie) ou bien des défauts d’activation plaquettaire (thrombopathies). Le laboratoire utilise aussi bien des mégacaryocytes en culture que des plaquettes, humaines et murines et des lignées cellulaires.
Un des axes de recherche porte sur l’implication du cytosquelette, des protéines de signalisation et de la régulation de la signalisation calcique, (notamment les pompes Serca3), dans la formation et l’activation des plaquettes. Le cytosquelette est un acteur essentiel par son implication sur leur formation, la morphologie des plaquettes, la sécrétion,… Mieux comprendre, mais également définir de nouveaux acteurs impliqués dans ces mécanismes, sont des enjeux essentiels notamment dans des pathologies induisant des défauts morphologiques (macro- ou microplaquettes) ou encore du nombre de plaquettes (thrombopénie) ou bien des défauts d’activation plaquettaire (thrombopathies). Le laboratoire utilise aussi bien des mégacaryocytes en culture que des plaquettes, humaines et murines et des lignées cellulaires.
 Un second axe de recherche porte sur la régulation de la quantité de plaquettes en périphérie. Dans cette thématique, notre laboratoire, s’intéresse tout particulièrement au rôle de l’acide sialique et l’exposition du β-galactose, un signal de sénescence régulant la clairance des plaquettes.
Un second axe de recherche porte sur la régulation de la quantité de plaquettes en périphérie. Dans cette thématique, notre laboratoire, s’intéresse tout particulièrement au rôle de l’acide sialique et l’exposition du β-galactose, un signal de sénescence régulant la clairance des plaquettes.
Enfin, un axe important de nos recherches porte sur l’étude de pathologies plaquettes connues telles que les filaminopathies A, la maladie de Willebrand de type 2B ou encore l’étude de pathologies associées à des évènements hémorragiques inexpliqués. Dans ce cadre, notre objectif est d’évaluer et de mieux comprendre les mécanismes moléculaires sous-jacents à ces pathologiques. Un second volet de cet axe porte sur le suivi de patients traités lors de protocoles cliniques (suivi des patients Wiskott-Aldrich traités par thérapie génique).
Pour mener à bien l’ensemble de ces études, nous disposons de modèles multiples, tels que :
– modèles animaux,
– accès à des échantillons de patients,
– lignées cellulaires primaires et développées au laboratoire,
– notre laboratoire travaille en étroite collaboration avec l’hôpital et la recherche clinique, ce qui est un atout majeur pour pouvoir faire un lien avec la recherche fondamentale et la recherche clinique.
| Régis | BOBE | CRHC |
| Frédéric | ADAM | CRCN |
| Alexandre | KAUSKOT | CRCN |
| Cécile | LAVENU-BOMBLED | MCU-PH |
| Jildaz | CAROFF | PH |
| Christelle | SOUKASEUM (MOREAU) | IE |
| Christelle | REPERANT | AI |
| Jean | SOLARZ | Doctorant |
| Toscane | VIELLARD | Doctorante |
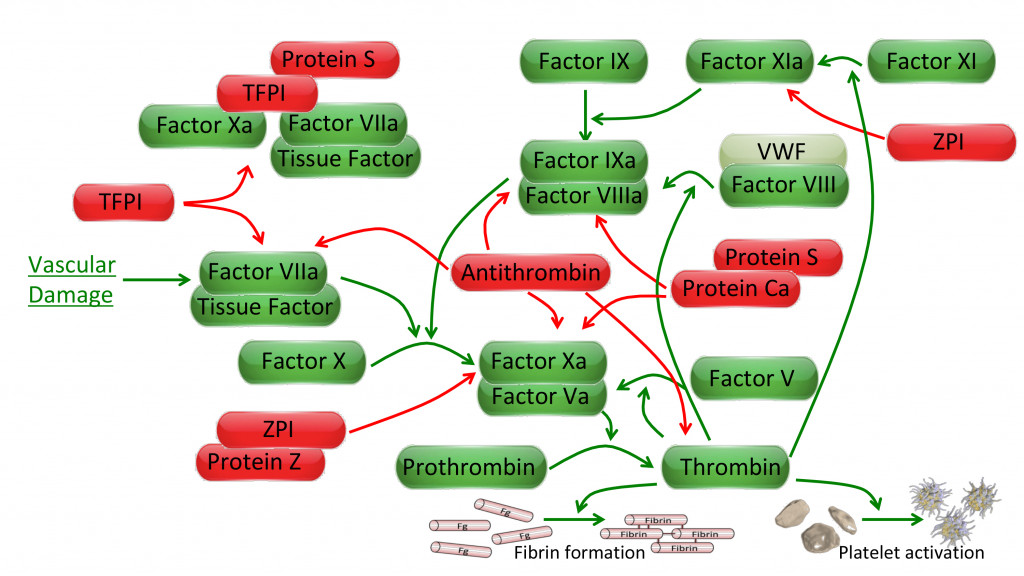
Les projets de recherche s’inscrivant dans ce thème s’articulent autour de la cascade de la coagulation (voir schéma ci-dessous) dont le but principal est l’arrêt du saignement lors d’une brèche vasculaire. Les molécules pro-coagulantes sont ici représentées en vert.
Nous nous intéressons particulièrement à l’étude des relations structure-fonctions des protéines de l’hémostase en nous focalisant sur celles qui sont absentes ou mutées dans des pathologies hémorragiques constitutionnelles. C’est le cas du facteur Willebrand dans la maladie de Willebrand, le facteur VIII dans l’hémophilie A ou le facteur IX dans l’hémophilie B. Notre intérêt s’étend également aux protéines qui peuvent être utilisées en thérapeutique pour traiter ces pathologies, comme le facteur X ou le facteur VIIa.
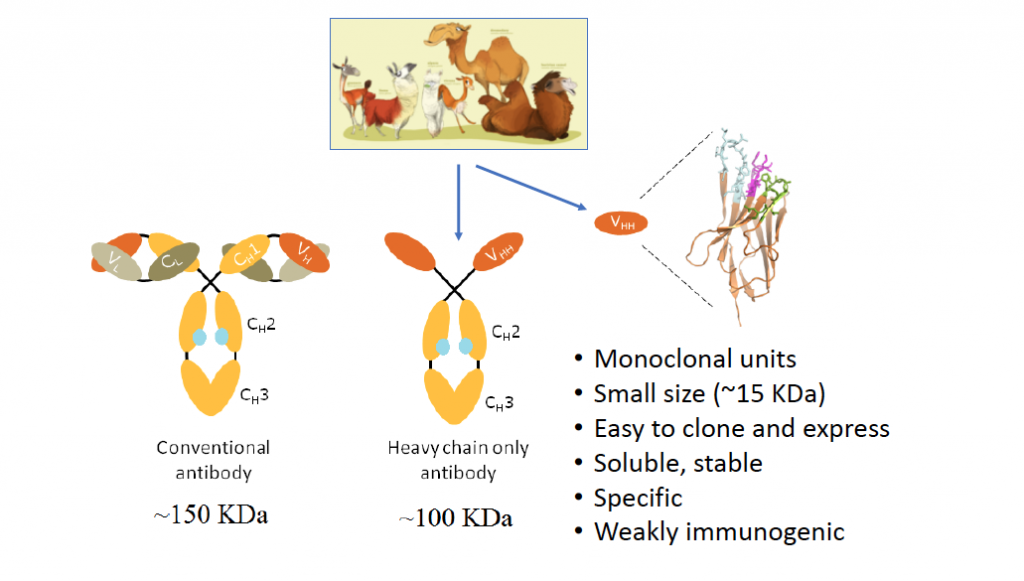
Afin d’étudier ces protéines, nous utilisons un certain nombre d’outils biologiques dont des nanobodies ou VHH (mini-anticorps développés par les camélidés) que nous développons au sein du laboratoire. Ces nanobodies sont d’une grande utilité d’une part en tant qu’outils de recherche pour mieux caractériser nos protéines d’intérêt mais aussi comme outils thérapeutiques potentiels.
 En effet, nous nous appuyons sur notre expertise de l’hémostase pour tenter de développer des thérapies innovantes pour le traitement des maladies hémorragiques que ce soit par des approches de thérapie génique ou encore par des approches plus classiques basées sur l’utilisation de protéines (nanobodies ou facteurs de la coagulation modifiés).
En effet, nous nous appuyons sur notre expertise de l’hémostase pour tenter de développer des thérapies innovantes pour le traitement des maladies hémorragiques que ce soit par des approches de thérapie génique ou encore par des approches plus classiques basées sur l’utilisation de protéines (nanobodies ou facteurs de la coagulation modifiés).
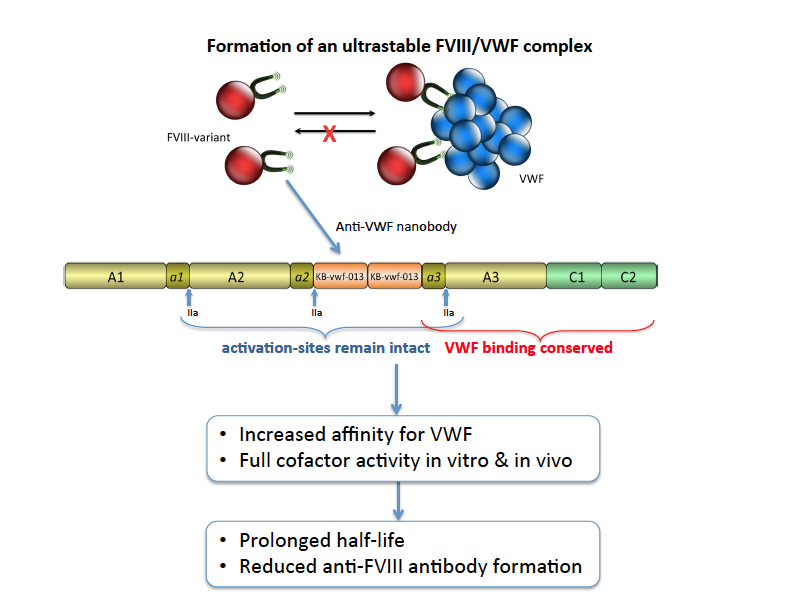
Ainsi, dans le domaine de l’hémophilie, nous avons développé une nouvelle molécule de facteur VIII, à faible immunogénicité et à durée de vie allongée :
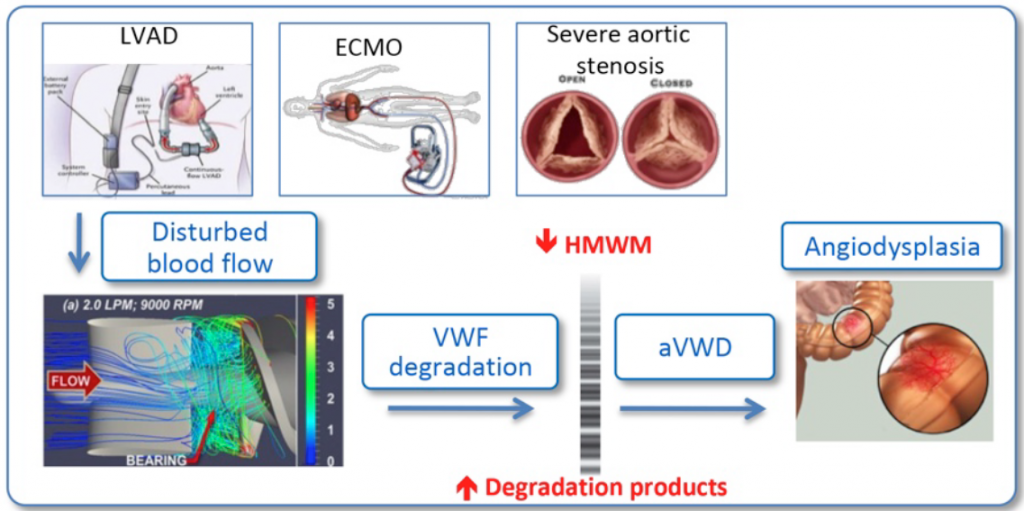
Dans le cadre de la maladie de Willebrand, nous développons en projet ambitieux dans le cadre du RHU WillAssistHeart, coordonnée par le Pr. Susen (CHU Lille). Ce projet vise à mieux comprendre la maladie de Willebrand acquise développée par les patients placés sous assistance circulatoire mécanique (ou souffrant de sténose aortique) et à répondre au challenge thérapeutique posé par les saignements (principalement gastro-intestinaux) observés chez ces patients. La figure ci-dessous résume l’hypothèse du mécanisme pathologique mis en jeu.
Nous travaillons en lien avec le Centre de Référence de la Maladie de Willebrand (CRMW) qui appartient à la filière santé maladies hémorragiques rares MHEMO.
Les projets proposés au sein du groupe bénéficient d’un certain nombre de financements académiques ou privés permettant leur bonne réalisation. Enfin, nos collaborations internationales et nationales nous permettent d’évoluer et de développer ces projets d’une manière efficace au niveau des outils/technologies complémentaires qui pourraient nous faire défaut.
Notre groupe est également impliqué dans des associations de patients telles que l’Association Française des Hémophiles (AFH). Des visites du laboratoire sont organisées régulièrement pour les patients.
| Cécile | DENIS | DR1 |
| Peter | LENTING | DRCE |
| Olivier | CHRISTOPHE | DR2 |
| Caterina | CASARI | CRCN |
| Dominique | MEYER | PU-PH |
| Cécile | LAVENU-BOMBLED | MCU-PH |
| Adeline | BLANDINERES | AHU |
| Roselyne | D’OIRON | PH |
| Stéphanie | ROULLET | PH |
| Ivan | PEYRON | IR Paris-Saclay |
| Marie | CLAVEL | IE (CDD) |
| Emilie | BOCQUET | IE (CDD) |
| Eloïse | PASCALE | IE (CDD |
| Geneviève | Mc CLUSKEY | Post-doctorante |
| Thibaud | SEFIANE | Doctorant |
| Sénadé | ATSOU | Doctorante |
| Alexis | TEXIER | Doctorant |
Les projets de recherche s’inscrivant dans ce thème s’articulent autour des anticoagulants naturels de la cascade de la coagulation (représentés en rouge sur le schéma ci-dessous). Nous nous intéressons non seulement à l’effet purement anti-coagulant de ces différentes molécules mais aussi à leurs effets cellulaires qui leur permettent d’être impliqués dans divers processus au-delà de l’hémostase et en particulier l’inflammation. Les protéines sur lesquelles nous nous focalisons particulièrement sont l’antithrombine, le complexe protéine Z/ZPI et le système de la protéine C.
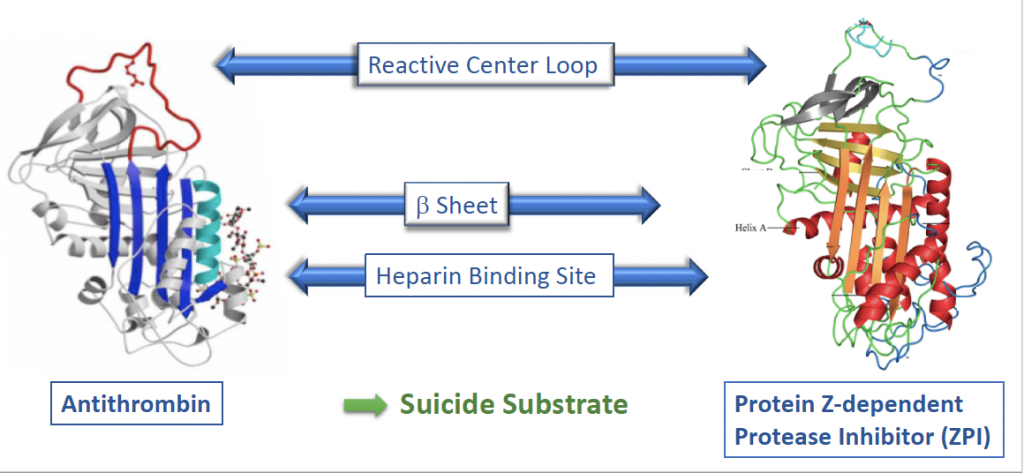
Ainsi, nous avons acquis une expertise importante sur l’étude des Serpines (Inhibiteurs de Sérine protéases) (voir schéma ci-dessous) grâce à nos travaux sur l’antithrombine.
Cette expertise nous a permis dans le passé de développer le premier antidote contre le fondaparinux basé sur l’utilisation d’une molécule d’antithrombine modifiée. Nos projets actuels sur les Serpines visent désormais 1) à cibler l’antithrombine dans un but de ré-équilibrer l’hémostase dans l’hémophilie et 2) à mieux comprendre les relations structure-fonctions de l’inhibiteur dépendant de la protéine Z, le ZPI qui est une des serpines les moins bien caractérisées jusqu’à présent. L’objectif est également de mieux comprendre le rôle du ZPI dans des pathologies inflammatoires et thrombotiques, mais également dans l’hémophilie. Pour cela, nous nous appuyons sur le développement au sein de notre groupe de nanobodies ou VHH (mini-anticorps développés par les camélidés) dirigés contre cette protéine.
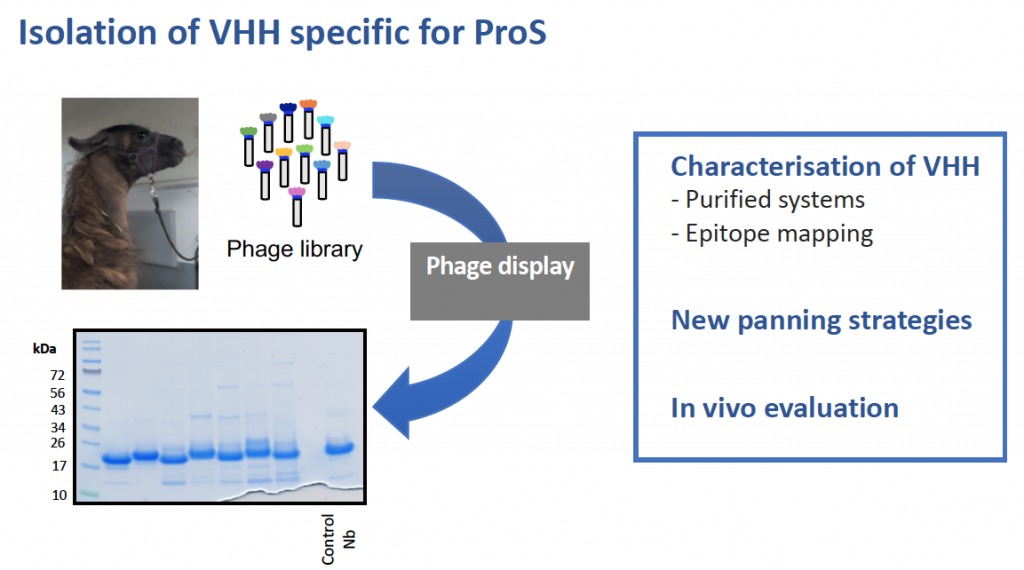
Concernant le système de la protéine C, notre focus porte principalement sur la protéine S et nous souhaitons évaluer s’il est possible de moduler l’activité anticoagulante de la protéine S en utilisant des nanobodies dirigés contre cette protéine. Egalement, de tels anticorps nous permettraient de mieux comprendre les déterminants moléculaires nécessaires aux différentes fonctions de la protéine S.
Au-delà des projets fondamentaux que nous développons, notre groupe a également une forte activité clinique et nous nous intéressons particulièrement aux anomalies congénitales de glycosylation (CDG) et aux défauts d’hémostase qui leur sont associés. Cette activité se fait en lien avec le Centre de Référence des anomalies congénitales de glycosylation coordonné au sein de l’hôpital Necker.
L’ensemble de ces projets bénéficient de collaborations internationales et nationales pour leur bon déroulement.
| Delphine | BORGEL | PU-PH |
| Marc | VASSE | PU-PH |
| Elsa | BIANCHINI | MCU |
| François | SALLER | MCU |
| Dominique | LASNE | PH |
| Tiffany | PASCREAU | Hospitalier Biologie Clinique |
| Sophie | MOOG | IE (CDD) |
| Mariem | KHAMARI | TR |
| Claire | AUDITEAU | Doctorante |
| Mouna | MAHMOUD | Doctorante |